乙硼烷
浏览: 35
导读:乙硼烷 : BH3BH3B2H6[1]又称六氢化二硼、二硼烷。无色气体。有特殊气味。微甜。可燃。相对分子质量27.67。相对密度0.447(-112℃,液体)。熔点-165.5℃。沸点-92.5℃。临界温度16.7℃。临界压力0.40MPa。在空气中的自燃温度为40~50℃,如有杂质存在时,自燃温度可降低,甚至形成乙硼烷与空气的爆炸混合物。赤热情况下,分解为硼
乙硼烷 :
BH3BH3 B2H6 [1]
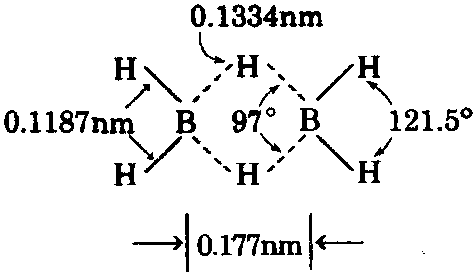
又称六氢化二硼、 二硼烷。无色气体。有特殊气味。 微甜。可燃。相对分子质量27.67。 相对密度0.447(-112℃, 液体)。熔点-165.5℃。沸点-92. 5℃。临界温度16.7℃。临界压力0.40MPa。在空 气中的自燃温度为40~50℃,如有杂质存在时, 自燃温度可降低,甚至形成乙硼烷与空气的爆 炸混合物。赤热情况下,分解为硼和氢,低温时 放出氢及其他硼氢化物。溶于二硫化碳和乙醚。 其分子结构如下图。
B2H6+6H2O→2H3BO3+4H2
与氨反应,生成乙硼烷二氨合物。与溴反应缓 慢;与氯发生爆炸性反应,将氢置换出来,生成 氯化硼。与烃或有机硼化合物反应,生成硼烷或 芳基硼。与烷基金属化合物反应,生成金属硼氢 化物。乙硼烷的还原性很强,可使重金属盐还原 为金属。可以制成像碱金属或碱上金属的汞齐 那样性质的金属加合物M2I(B2H6)或 MI(B2H6)。与醇类反应,产生氢气,同时转变 为酯。B2H6+4CH3OH→2HB(OCH3)2+4H2
与一氧化碳反应生成BH3CO。密封贮存时,转 变为氢及高级硼烷。易被碱分解为硼和氢。与能 给出强电子对的物质反应,可生成硼加合物。本 品有毒,吸入其蒸气,引起肺水肿。工作场所最 高允许浓度0.1×106。用途: 乙硼烷可用作链烯烃聚合时的催化 剂、橡胶硫化剂、还原剂、火箭燃料;制备烷基芳 烃衍生物的有机金属化合物;其他硼烷的原料; 掺合气;利用乙硼烷的热分解,可在金属表面涂 敷硼层,提高硬度、抗氧化、耐腐蚀等性能。
制法: ①在无水乙醚中使硼(Ⅲ)氢化 锂(LiBH4)或氢化铝锂与氟化硼作用,可制 得[1]。
BF3+3LiBH4→[1]+3LiF
16BF3+3LiAlH4→2[1]+3Al(BF4)3
+3LiBF4
②使丁硼烷在100℃下加热5h,或使三氯 化硼及氢的混合气在减压下(1.33×104Pa)用铜 电极放电。
③ 用硼(Ⅲ)氢化钾与磷酸反应,可制 得[1]。
![]()
 客服热线:
客服热线:


