乙醛
浏览: 1
导读:乙醛 : CH3CHO C2H4O[1]又称Ethanal、Acetic aldehyde、Ethylaldehyde。无色流动性液体。有可燃性。有辛辣刺激性气味。略有香气和青草气。天然存在于苹果、草莓、菠萝等水果中。易挥发。1774年Scheele首先制得。相对分子质量44.05。相对密度0.7834(18℃)、0.7830。熔点-121℃。沸点20.8℃。闪点-78℃(闭式)。折射率1.3316。
乙醛 :
CH3CHO C2H4O [1]
又称Ethanal、 Acetic aldehyde、Ethylaldehyde。无色流动 性液体。有可燃性。有辛辣刺激性 气味。略有香气和青草气。天然存 在于苹果、草莓、菠萝等水果中。 易挥发。1774年Scheele首先制 得。相对分子质量44.05。相对密度0.7834 (18℃)、0.7830。熔点-121℃。沸点20.8℃。 闪点-78℃(闭式)。折射率1.3316。156℃时在空 气中可自燃。临界温度181.5℃,临界压力 4.404MPa。与水、乙醇、乙醚、氯仿和苯可任意 混溶,也溶于丙酮。本品与丁烷、乙醚、1,3-丁 二烯形成共沸混合物,本品含量(质量分数,%) 为16.0、76.0及52.0,共沸点分别为-7.0℃、 20.5℃及50℃。蒸气压(×103Pa):2.506 (-50℃)、16.398(-20℃)、43.996(0℃)、67.700 (10℃)、82.897(15℃)。本品具有醛类的化学通 性,羰基可以进行加成、醇醛缩合、聚合、缩合等 反应;与羟胺反应,生成乙醛肟;在碱催化剂作 用下与氰化氢加成,生成丙腈;易还原生成乙 醇;易氧化生成乙酸或过乙酸;在氧存在下可以 聚合为三聚乙醛,但在硫酸作用下,又解聚为 乙醛,可不断蒸出乙醛蒸气。甲基上的氢原子 能被卤化,生成卤化物;气相氯化时,可生成乙 酰氯;与五氯化磷反应生成1,1-二氯乙烷;在 无水氯化铝作用下,与四氯化碳反应,生成光 气;与次氯酸钠反应,生成氯仿;也可与溴反应, 生成三溴乙醛。加热至400℃以上,分解为甲烷 及一氧化碳。除此之外,本品的蒸气与空气形 成爆炸混合物,爆炸极限4.0%~57.0%(体积分 数)。本品刺激皮肤和粘膜,对中枢神经有麻醉 作用,长期慢性中毒,引起肝障碍。大鼠经口 LD501900mg/kg。工作场所最高允许浓度 200×10-6。
用途: 用作三聚乙醛、乙酸、乙酐、巴豆醛、 过乙酸、乙酸乙酯、正丁醇、辛醇、季戊四醇、三 氯乙醛水合物、丁醇醛、合成树脂;苯胺染料、塑 料、合成橡胶、甲乙胺、乙二胺、吡啶、甲基吡啶 和银镜反应等的原料。但由于采用了甲醇的羰 基化生产乙酸新工艺后,这方面用量迅速下降; 同样,由于采用丙烯羰基合成新工艺后,这方面 的用量也明显下降。我国GB2760—1996规定暂 时允许用作食用香料,配制果香型香精。
制法: ①乙烯直接氧化的赫希斯特-瓦克 法(Hoechst-Wacke)。在氯化钯和氯化铜催化 剂的作用下,用空气或氧气氧化,氧化方法有二 种,一种方法是一步法,一步法又称氧气法或赫 希斯特法,即在装有催化剂溶液的反应器中,通 入乙烯、氧和循环气,在0.3MPa、120~130℃下 进行反应,反应后,生成的乙醛、未反应的乙烯、 氧以及因反应放出的热而产生的水蒸气,一起 在吸收塔中用水吸收,而与乙醛分离。分离后的 乙醛,再进行减压精馏,与水蒸气分离,可制 得[1]。反应过程中氯化钯变为金属钯,而失去 催化剂的活性,加入氯化铜后,使钯重新成为氯 化钯,而又恢复活性,还原后的氯化亚铜,被氧 气氧化,又恢复为氯化铜。
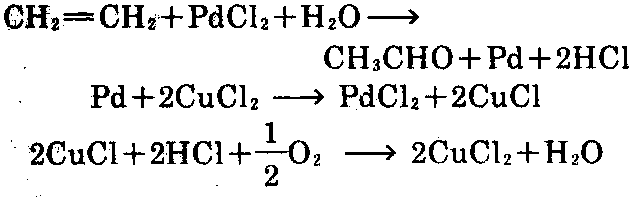
②乙醇脱氢法。乙醇在260~290℃下气化, 在铜-锌或铜-铝催化剂作用下脱氢,可制得[1]。
③ 乙醇氧化法。将浓度为90%左右的乙 醇,加热至其沸点85℃,预热至300℃,在反应器 中银等催化剂作用下,用预热至300℃的空气进 行催化氧化,催化床层温度维持在330~500℃。 由于是放热反应,反应后的热气体,与进入床层 的冷气体,进行热交换,一方面降低反应后气体 温度,使乙醛冷凝,另一方面,加热进入床层的 乙醇、空气,使之达到反应所需温度。反应器压 力为0.12~0.2MPa。冷凝后的乙醛,再在减压 下精馏精制。
④ 乙酸钙和甲酸钙一起干馏。
 客服热线:
客服热线:


