四氯化碳
导读:四氯化碳 : CCl4[1]又称四氯甲烷、全氯甲烷、Necatorina、Benzinoform。1839年首次制得。无色透明液体。有特殊气味。不易燃。相对分子质量153.84。相对密度1.5940。熔点-22.87℃。沸点76.5℃。折射率1.4601。粘度1.329mPa·s(0℃)、0.965mPa·s(20℃)。蒸气压(×103Pa): 4.410(0℃)、11.939(20℃)、18.612(30℃)、28.118(40
四氯化碳 :
CCl4 [1]
又称四氯甲烷、全氯甲烷、Necatorina、 Benzinoform。1839年首次制得。无 色透明液体。有特殊气味。不易燃。相 对分子质量153.84。相对密度1.5940。熔点 -22.87℃。沸点76.5℃。折射率1.4601。粘度 1.329mPa·s(0℃)、0.965mPa·s(20℃)。蒸气压 (×103Pa): 4.410(0℃)、11.939(20℃)、18.612 (30℃)、28.118(40℃)、41.196(50℃)、58.528 (60℃)、81.833(70℃)。本品可与乙醇形成共沸 混合物,共沸点65℃,此时本品含量84%;也可 与丙酮组成共沸混合物,共沸点56℃,本品含量 11.5%;与水组成共沸混合物,共沸点66℃,本品 含量95.9%。微溶于水,25℃时0.08,溶于乙醇、 乙醚、丙酮、苯、二硫化碳和氯仿。四氯化碳分子 呈四面体结构,是非极性分子。化学反应性呈惰 性,但较氯仿活泼。在250℃下,有水存在时,能 和某些金属反应,产生二氧化碳;如果无水存在 时,则四氯化碳与金属的反应很慢。
CCl4+2H2O→CO2+4HCl
四氯化碳在铝、铁等金属存在下(催化)被水分 解。如果是过热蒸汽,虽然无金属催化剂存在, 四氯化碳也能被分解,产生光气。CCl4+H2O→COCl2+2HCl
在加热情况下,四氯化碳能与卤盐反应,生 成其他四卤化物,如与氟化银反应,可生成四氟 化碳;与溴化铝、碘化钙反应,可生成四溴化碳 和四碘化碳。
在微量氯化氢存在下,本品能与高氯酸银 反应,生成爆炸性化合物Cl3CClO4:
CCl4+AgClO4→Cl3CClO4+AgCl
在五氯化锑催化剂存在下,本品与氟化氢 反应,可以生成氟氯甲烷,如一氟三氯甲烷、二 氟二氯甲烷,即氟利昂制冷剂。
CCl4+HF→CCl3F+HCl
CCl4+2HF→CCl2F2+HCl
四氯化碳在高温下(200℃以上)与硫反应 生成二硫化碳。
CCl4+6S→CS2+2S2Cl2
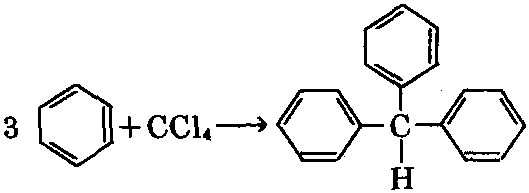
在无水氯化铝催化作用下,四氯化碳与苯 反应,生成三苯基甲烷。
在铁或铁盐的催化作用下,加热至330℃能 促使四氯化碳氧化分解,生成光气。
2CCl4+O2→2COCl2+2Cl2
四氯化碳虽有麻醉性,但较氯仿小。本品有 毒。工作场所最高允许浓度为10×10-6。
用途: 因为四氯化碳受热时,立即挥发成 很重的气体,可将火包围起来,与空气隔绝,因 此,可用作灭火剂;用作溶剂和干洗剂;谷物熏蒸 杀虫剂;有机合成时的氯化剂;香料浸出剂;分析 试剂;聚氨酯发泡剂及医药麻醉剂。
制法:①丙烯与过量氯反应,生成氯烃混 合物,然后精馏分离,可获得[1]。
②二硫化碳在碘催化剂作用下,与干燥氯 气反应,可制得[1],同时生成氯化硫,然后精馏 分离。催化剂也可用三氯化铝或五氯化锑。
2CS2+6Cl2→2[1]+2S2Cl2
2S2Cl2+CS2→[1]+6S
③高温下,烷烃氯化断链可制得[1]。
C3H8+9Cl2→[1]+C2Cl6+8HCl
④ 甲烷在高温下(450℃)氯化,可生成 [1],然后,精制分离。
CH4+4Cl2→[1]+4HCl
⑤甲烷氧氯化法。以氯化铜及氯化亚铜混 合物为催化剂,以甲烷、空气、氯气为原料,可制 得[1]。
 客服热线:
客服热线:


