化学反应速度
导读:化学反应速度 : 简称“反应速度”。在化学反应系统的单位体积(V)中,物质(反应物或产物)的摩尔数(n)随时间(t)的变化。反应速度r的数学表示式为:。按习惯,反应速度始终取正值,故当以反应物的摩尔数减少来表示时,数学式前加“-”号,而当以产物的摩尔数增加来表示时,则取“+”号。若反应的总体积不变,则rc=,式中C=n/V,即反应速
化学反应速度 : 简称“反应速度”。在化学反应
系统的单位体积(V)中,物质(反应物或产
物)的摩尔数(n)随时间(t)的变化。反应
速度r的数学表示式为:
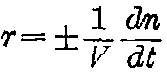 。按
习惯,反应速度始终取正值,故当以反应物
的摩尔数减少来表示时,数学式前加“-”
号,而当以产物的摩尔数增加来表示时,则
取“+”号。若反应的总体积不变,则rc=
。按
习惯,反应速度始终取正值,故当以反应物
的摩尔数减少来表示时,数学式前加“-”
号,而当以产物的摩尔数增加来表示时,则
取“+”号。若反应的总体积不变,则rc=
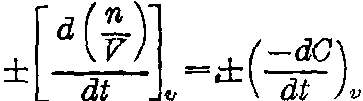 ,式中C=n/V,即
反应速度可用浓度C(对气体反应也可用
*分压力)随时间的变化来表示。对于aA
+bB→eE+fF的反应,若没有副反
应,各物质的浓度变化符合化学计量关系。
当用不同物质的浓度来表示反应速度时,
它们之间应有下列关系:
,式中C=n/V,即
反应速度可用浓度C(对气体反应也可用
*分压力)随时间的变化来表示。对于aA
+bB→eE+fF的反应,若没有副反
应,各物质的浓度变化符合化学计量关系。
当用不同物质的浓度来表示反应速度时,
它们之间应有下列关系:
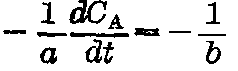
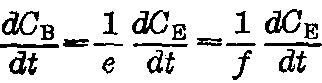 ,或
,或
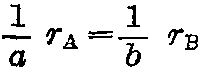
 。式中rA、rB、rE、rF分别
为以反应物A或B与产物E或F表示的
反应速度,a、b、e、f为相应物质在反应式
中的计量系数。大多数化学反应的速度与
浓度的关系可表达为幂函数形式: r=
kcAαcBβ…,此式称为“动力学方程式”,k是反
应速度常数,α与β是实验测定的反应级
数。影响反应速度的因素,除反应物与产
物自身的性质与浓度外,尚有温度、压力、
溶剂、催化剂、光、电等,它们在动力学方程
式中可以有适当的反映。
。式中rA、rB、rE、rF分别
为以反应物A或B与产物E或F表示的
反应速度,a、b、e、f为相应物质在反应式
中的计量系数。大多数化学反应的速度与
浓度的关系可表达为幂函数形式: r=
kcAαcBβ…,此式称为“动力学方程式”,k是反
应速度常数,α与β是实验测定的反应级
数。影响反应速度的因素,除反应物与产
物自身的性质与浓度外,尚有温度、压力、
溶剂、催化剂、光、电等,它们在动力学方程
式中可以有适当的反映。
 客服热线:
客服热线:


